La prochaine édition aura lieu les 24, 25 et 26 septembre 2026.
Sommaire de la page
Public concerné
Ce programme de formation s’adresse aux responsables de la réglementation, aux mandataires brevets et aux juristes internes, ainsi qu’aux fonctionnaires travaillant pour des organisations de santé publique, qui doivent naviguer entre les nombreux domaines juridiques pertinents pour la recherche, le développement et l’innovation pharmaceutique.
Langue d’enseignement : anglais
Programme
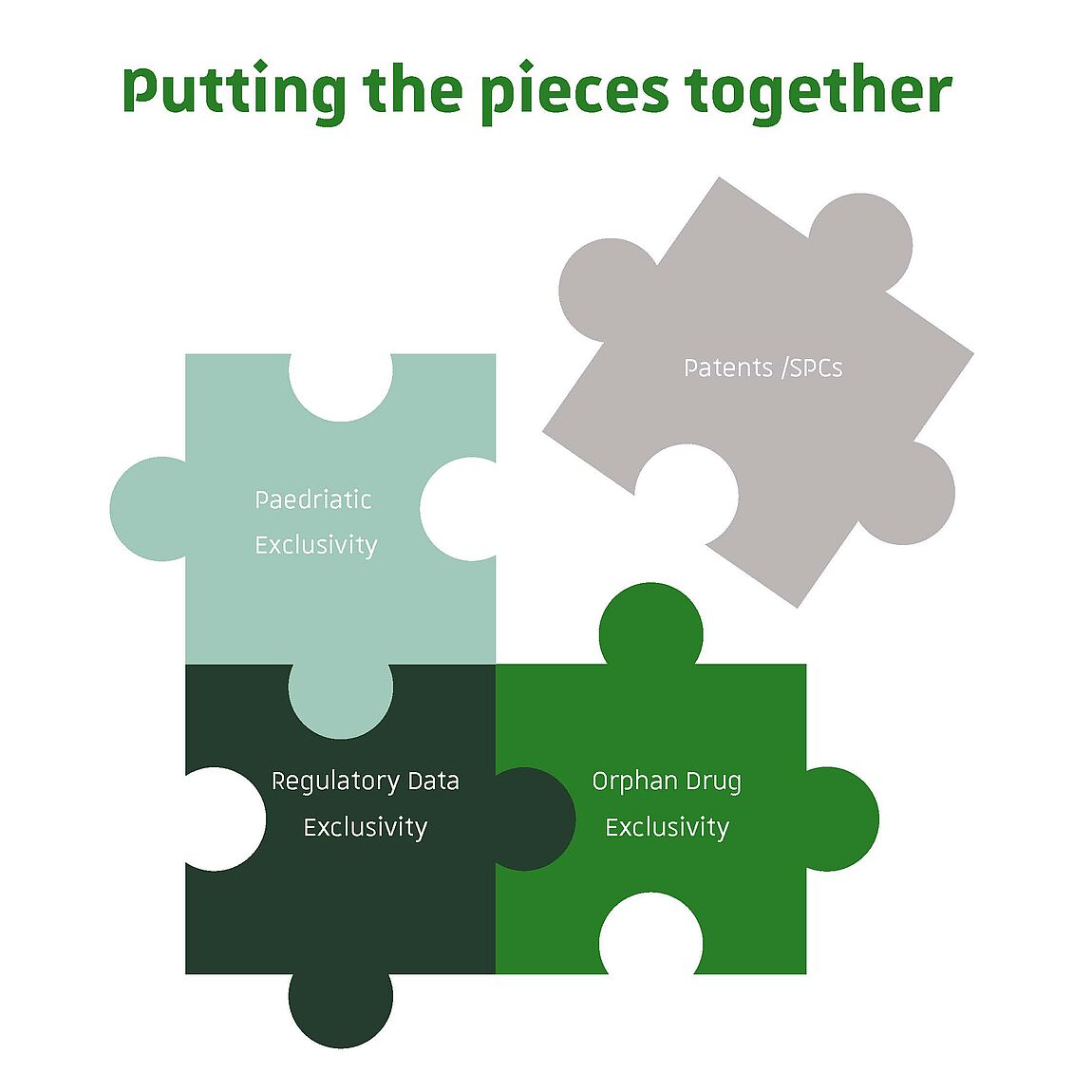
Le CEIPI propose depuis 2019 un programme de formation avancé sur les aspects réglementaires et la Propriété Intellectuelle dans l'industrie pharmaceutique, une proposition pédagogique unique destinée aux professionnels de la PI et de la réglementation dans le secteur pharmaceutique. Les trois jours de formation sont articulés autour des interactions entre le droit des brevets, les certificats complémentaires de protection et la protection des données réglementaires.
Le développement, l'autorisation et la commercialisation des médicaments dans le secteur pharmaceutique comptent parmi les domaines les plus réglementés et les plus complexes du droit de l'Union européenne (UE). Le cadre juridique régissant la réglementation des médicaments peut affecter un large éventail de droits privés, de droit de la propriété intellectuelle, de droit de la concurrence et de droit de la consommation. En particulier, les brevets, les certificats complémentaires de protection (CCP) et les avantages réglementaires, notamment la protection des données réglementaires, constituent un cadre juridique complexe, caractérisé par des exclusivités qui se chevauchent et impactent à la fois l'innovation et la concurrence. Cette complexité représente un défi pour les experts chargés de comprendre un paysage juridique et réglementaire en constante évolution.
Le programme de formation avancée du CEIPI sur les affaires réglementaires et la protection de la propriété intellectuelle dans l'industrie pharmaceutique, qui en est à sa cinquième édition, est une offre pédagogique unique destinée aux professionnels de la réglementation et de la propriété intellectuelle du secteur pharmaceutique. Ces trois jours de formation intensive s'articulent autour des croisements entre le droit des brevets et le droit réglementaire. À cet égard, des questions telles que les CCP et la protection des données réglementaires, entre autres sujets pertinents, seront abordées par des juristes et des experts de renom.
Ce cours interactif vise à fournir un aperçu actualisé de l'environnement réglementaire, des procédures et des obligations pharmaceutiques européennes, ainsi que du paysage des brevets et des CCP. Il offrira un espace de discussion sur l'interprétation et l'application de la législation dans ce secteur à la lumière des nouvelles évolutions. Ces évolutions incluent un aperçu de l'état actuel des propositions de la Commission européenne pour la révision de la législation pharmaceutique européenne et de la législation relative aux CCP.
Téléchargez le programme de l'édition 2025 (programme 2026 mis en ligne prochainement)
Liste des intervenants
Nature et sanction de la formation
La formation donne lieu à la délivrance d’un certificat de réalisation.
Frais de participation (susceptibles d'évolution en 2026) et inscription
Professionnels :
- 1 685 € TTC (tarif préférentiel) avant le (date précisée ultérieurement)
- 1 885 € TTC (plein tarif) pour toute inscription après le (date précisée ultérieurement)
Étudiants :
- 525 € TTC* (Formation initiale)
*sous réserve de la validation par les instances universitaires
Les candidats doivent compléter un formulaire de pré-inscription en ligne: Ouverture des inscriptions le 16 mars 2026.
Durée
Le séminaire a une durée totale de 18 heures, réparties sur les trois jours.
Horaires
Le séminaire se déroule entre 9h et 18h les jours de semaine, et entre 9h et 13h le samedi.
Ces horaires sont donnés à titre indicatifs et peuvent être modifiés à la marge.
Lieu
Strasbourg et à distance.
Responsables scientifiques
Le programme est conçu et dirigé conjointement par :
- Peter Thomsen, President of the EPI
- Alexander Meier, Associé chez Morgan, Lewis & Bockius LLP
- Pierick Rousseau, Ancien directeur Propriété intellectuelle chez Pierre Fabre
- Thomas Lemieux, Enseignant-chercheur au CEIPI
Contact
Pour toute question ou information complémentaire, vous pouvez envoyer un email à : pharma-seminar[at]ceipi.edu
Annexes pédagogiques
Document 2026 mis en ligne prochainement.